Redoxpotential / ORP-Wert
Das Phänomen der Verbrennung war der erste Vorgang bei dem die Redoxspannung nachgewiesen wurde. Es ist anzunehmen, dass jeder brennbare Stoff einen „Feuerstoff“ (Phlogiston) enthalte und dieser bei der Verbrennung freigesetzt wird.
Der französische Chemiker Lavoisier erkannte erst Mitte des 18. Jahrhunderts, dass bei der Verbrennung Sauerstoff verbraucht wurde. Allen Vorgängen, bei denen ein Stoff mit Sauerstoff reagierte, übertrug er den Namen Oxidation. Als Reduktion bezeichnete er die Rückführung des entstandenen Metalloxids in seinen ursprünglichen Zustand.
Auch viele andere Reaktionen der Chemie unterscheiden sich äußerlich nicht von der Verbrennung, aber an ihnen ist kein Sauerstoff beteiligt. Beispiele hierfür sind:
- Reaktion von erhitztem Natrium mit Chlor
- Reaktion von Wasserstoff mit Chlor
- Reaktion von Schwefel mit Chlor
Bei näherer Betrachtung der Vorgänge, die sich bei der Verbrennung von Natrium in Chlor abspielen, erkennt man, dass das Metallatom sein Außenelektron abgibt und zu einem positiv geladenen Ion (Kation) wird. Das freigewordene Elektron wird vom Chloratom aufgenommen, das dadurch zu einem negativ geladenen Ion (Anion) wird.
Die Ursache hierfür liegt in der so genannten Oktett-Regel. Diese besagt, dass viele Atome Moleküle oder Ionen bilden, bei denen die Anzahl der Elektronen auf der äußeren Schale, der eines Edelgases entspricht. Das kennzeichnende Merkmal der Oktett-Regel ist, dass die äußerste Schale komplett mit acht Außenelektronen besetzt ist. Diese stabile Konfiguration wird als Edelgaskonfiguration bezeichnet.
Als Oxidationsmittel werden Substanzen bezeichnet, die anderen Stoffen Elektronen entziehen können (sie oxidieren können). Es sind also nicht nur Stoffe, die leicht Sauerstoff abgeben können, sondern alle Stoffe, die in der Lage sind, Elektronen aufzunehmen. Auf der anderen Seite sind alle Stoffe, denen leicht Elektronen entzogen werden können, als Reduktionsmittel zu bezeichnen.
In der Technik von großer Bedeutung ist die Reduktion von Metalloxiden mit unedlen Metallen. Ein Beispiel für solch eine Reaktion ist der Hochofenprozess für die Stahlgewinnung. Dabei kommt es zu einer Redox-Reaktion zwischen den Eisenoxid-Erzen und der zugefügten Kohle als Reduktionsmittel. Bei den Verdrängungsreaktionen fällt auf, dass man die Stärke von Oxidations- und Reduktionsmitteln leicht in einer Redoxreihe festlegen kann. Dies erreicht man durch einen Vergleich ihrer Redoxpotenziale. Anhand dieser Redox-Reihe kann man den oxidierenden oder reduzierenden Charakter einer Spezies ablesen.
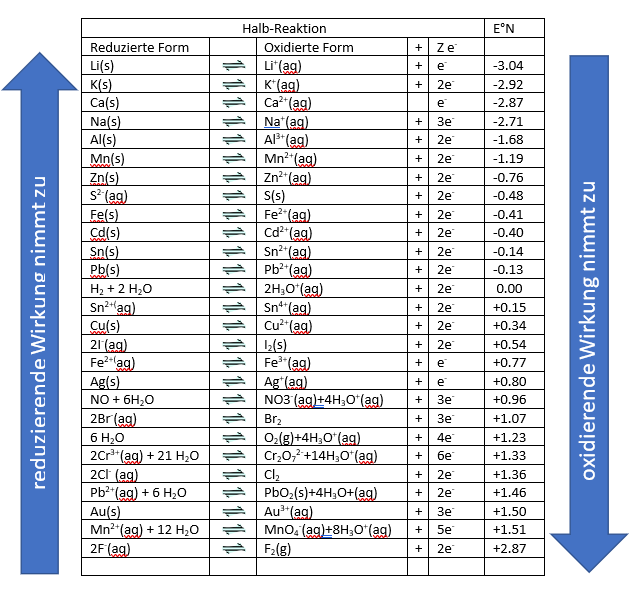
- auf der linken Seite steht die reduzierte Form
- auf der rechten Seite die oxidierte Form und die Anzahl der abgegebenen Elektronen
- von oben nach unten nimmt das Oxidationspotenzial zu
Jedes Metall verdrängt das in der Reihe über ihm stehende Metall aus seiner Salzlösung. Häufig spricht man von edlen Metallen und unedlen Metallen.
Die edlen, chemisch nur schwer angreifbaren Metalle stehen unten in der Spannungsreihe: Silber (Ag), Gold (Au), Platin (Pt). Dementsprechend sind an der Spitze die unedlen Metalle angesiedelt: Natrium (Na), Kalium (K), Magnesium (Mg).
Die Ursache für das Entstehen dieser Redox-Spannung ist also im unterschiedlichen Verhalten der Metalle zu sehen. Ob jetzt ein Metall als Oxidations- oder als Reduktionsmittel wirkt, ist sehr stark vom Reaktionspartner abhängig.
Um eine Redox-Spannung genau messen zu können, wird eine Messzelle verwendet. Den Aufbau einer Messzelle aus einem Metall und seiner entsprechenden Salzlösung nennt man Halbelement. Um die Spannung zu messen, werden zwei Halbelemente zu einem Element zusammengeschlossen. Die zwischen den Metallstäben auftretende Spannung wird als Maß, für das Bestreben eines Stoffes in Lösung zu gehen, herangezogen.
Eine aus zwei Halbelementen zusammengesetzte Zelle wird auch galvanische Zelle genannt. Dabei wird chemische Energie (in Form der Salzlösungen) in elektrische Energie (Gleichspannung) umgewandelt.
Für die verfahrenstechnische Einbindung einer Redox-Messung sind folgende Bestandteile vorzusehen.
Zum anderen werden inerte Edel-Metallelektroden (i.d.R. aus Platin oder Gold) eingesetzt. Diese bestehen aus einem Glas- oder Kunststoff Schaft, an dessen unterem Ende ein Metallstück bestimmter Form eingeschmolzen ist (Pt-Kuppe, Pt- oder Au-Stift). In Verbindung mit einer Bezugselektrode entsteht eine komplette Messkette. Die Bezugselektrode (i.d.R. Kalomel -Hg2CI2 oder Silber – Ag/AgCI) hat die Aufgabe, bei potenziometrischen Messungen ein konstantes Potenzial zu liefern, gegen welches das Potenzial der Metallelektrode gemessen wird. Sie besteht aus einem Glas- oder Kunststoff Schaft, der mit dem Bezugselektrolyten gefüllt und mit einem Ableitsystem versehen ist. Ein Diaphragma in der Schaftwand, stellt die leitende Verbindung zwischen dem Elektrolyten und dem Messmedium her. Eine Redox-Einstabmesskette enthält Metall- und Bezugselektrode in einem Schaft und stellt somit eine komplette Messkette dar. Es wird nur eine Einbaustelle benötigt. Bei der Auswahl der Elektrode ist der jeweilige Einsatzbereich zu berücksichtigen. Die Geometrie sowie verwendeten Materialien der Elektroden unterscheiden sich je nach Anwendungsbereich stark voneinander und sind für den jeweiligen Anwendungsfall optimiert.
Um eine einwandfreie Übertragung des Messsignals zu erhalten, werden in der pH- und Redox-Messtechnik nur spezielle Koaxialleitungen verwendet. Sie stellen die elektrische Verbindung zwischen dem Sensor und dem Messumformer her.
Es wird außerdem ein Messumformer verwendet. Dieser hat die Aufgabe, das Signal der Redox-Elektrode aufzubereiten. Im einfachsten Fall ist dies mit einem Zweidraht-Messumformer zu realisieren. Hierbei wird das Elektrodensignal in ein Signal von 4 – 20 mA umgewandelt und kann so direkt an eine nachgeschaltete SPS weitergegeben werden. Hier wird der Redox-Wert angezeigt und geregelt.
In der Industrie werden Redox-Messungen in den folgenden Anwendungen berücksichtigt:
- Cyanid-Entgiftung
- Chromat-Reduktion
- Nitritoxidation
- Schwimmbadwasser-Überwachung
- Trinkwasserüberwachung
- Indirekte Überwachung oxidativer Biozide in z.B. Kühlkreisläufen
Für den praktischen Einsatz sind eine Vielzahl von Messgeräten am Markt verfügbar. Diese lassen sich grundsätzlich in die beiden Hauptgruppen der:
- Handmessgeräte: ermöglichen die schnelle Vor-Ort Bestimmung sowie labortechnische Überwachung von Versuchsaufbauten
sowie
- On-Site Messumformern bzw. Prozess-Steuer Geräten: vereinen die Messung mehrerer Parameter inkl. prozessspezifischer Verarbeitung der Messwerte und deren Weitergabe mittels analoger oder digitaler Datenübertragung
unterteilen.
Von besonderer Bedeutung ist das Redoxpotential bspw. in der Überwachung von Schwimmbadwasser. Hierbei dient der Messwert als physikalische Größe zur Beurteilung der oxidierenden bzw. desinfizierenden Wirkung des vorhandenen Desinfektionsmittels (z.B. Chlor) unter Berücksichtigung der zum Messzeitpunkt im Wasser vorhandenen Verunreinigungen. Die keimtötende Wirkung von Oxidationsmitteln wie Chlor basiert hierbei auf der Anhebung des Redoxpotentials, durch deren Zugabe zum behandelnden Wasser. Hierdurch wird aktiv eine Störung des Keim-Stoffwechsels herbeigeführt und der Mikroorganismus stirbt ab. Hierbei ist zu beachten, dass für das Redoxpotential eine direkte Abhängigkeit zum pH-Wert besteht. Aus diesem Grund werden beide Werte immer zusammen erfasst. Je höher das Redoxpotential, desto schneller läuft dieser Prozess ab. Die sogenannte Keimtötungsgeschwindigkeit für 99,9% E-Coli liegt bei einem pH—Wert von 7 und einem Redoxpotential von 750 mV bspw. bei wenigen Sekunden.
Ein weiterer Anwendungsfall für den Einsatz der Redox-Messung ist die indirekte Konzentrationsüberwachung von oxidativen Bioziden in Kühlkreisläufen. In dieser Anwendung kommen je nach Betriebsweise und Anlagenkonzept nicht-oxidierende oder oxidierende Biozide zum Einsatz. Ein Nachteil nicht oxidierender Biozide liegt darin, dass im Kühlwasserkreislauf existente Bakterien Resistenzen gegen das eingesetzte Biozid ausbilden können. Aus vorstehendem Grund empfiehlt sich somit der alternierende Einsatz von mindestens zwei unterschiedlichen nichtoxidierenden Bioziden. Der Einsatz nicht oxidierender Biozide erfolgt in der Regel vor dem Hintergrund der sehr guten Materialverträglichkeit dieser Produkte.
Oxidierende Biozide hingegen greifen die verbauten Werkstoffe an, haben jedoch den Vorteil, dass sich diese indirekt über eine Messung des Redoxpotentials überwachen lassen. Der gemessene Redoxwert gibt hierbei Aufschluss über die aktuell im Kreislauf vorherrschende Desinfektionswirkung. Beim Einsatz oxidierender Biozide wird zur Vermeidung von hieraus potentiell resultierenden Korrosionsschäden dem Umlaufwasser ein sogenannter Korrosionsinhibitor zugefügt.